“Phân tử là gì” chắc chắn là câu hỏi nhiều bạn thắc mắc bởi đây là một kiến thức khá quan trọng trong chương trình hóa học lớp 6 và lớp 8. Hãy cùng thegioimay.org tìm hiểu kiến thức xoay quanh phân tử qua bài viết sau nhé!
Nội dung chính
Phân tử là gì, ví dụ?

Trước khi tìm hiểu phân tử là gì thì chúng ta cần xem xét qua khái niệm nguyên tử trước.
Khái niệm nguyên tử trong hóa học 8
Nguyên tử là một loại hạt có kích thước vô cùng nhỏ, trung hòa về điện, gồm hai thành phần cơ bản là: Lớp vỏ electron và phần hạt nhân. Trong đó, lớp vỏ mang điện tích âm còn phần hạt nhân mang điện tích dương.
Tìm hiểu phân tử là gì? Cho ví dụ
Hiểu một cách đơn giản nhất, phân tử là sự kết hợp giữa hai hoặc nhiều nguyên tử với nhau để tạo thành một chất. Các nguyên tử này có thể cùng thuộc một nguyên tố hay khác nguyên tố đều được. Vì lý do này mà người ta thường nói: Phân tử chính là hạt đại diện cho chất.
Người đầu tiên tiếp cận với khái niệm phân tử chính là nhà hóa học Amedeo Avogadro vào năm 1811. Thế nhưng, tới 100 năm sau, tức là năm 1911, nhà vật lý lượng tử kiêm nhà hóa học Jean Baptiste Perrin công khai kết quả nghiên cứu của ông thì khái niệm phân tử mới bắt đầu được sử dụng phổ biến.
Ví dụ về phân tử: Phân tử chất khí hidro H2, phân tử khí oxy O2, phân tử nước H2O, phân tử axit clohidric HCl,…
Phân biệt phân tử, nguyên tử như thế nào?
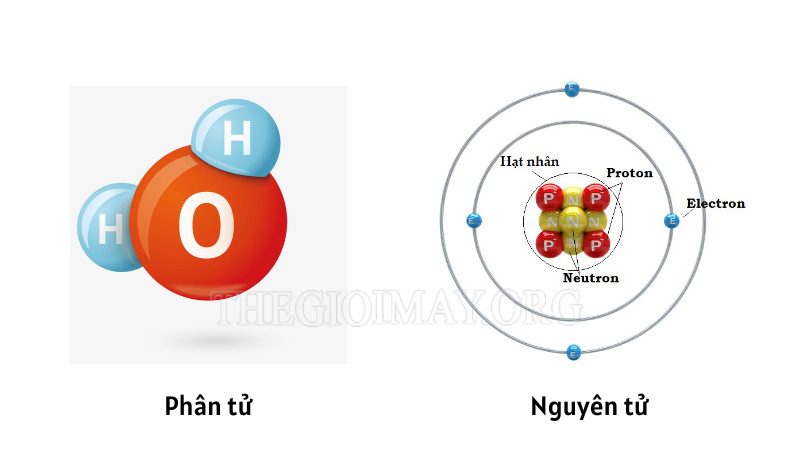
Ở nội dung trên, bạn và thegioimay.org đã biết khái niệm nguyên tử và phân tử là gì rồi, đồng thời chúng ta nhận định được chúng có sự khác nhau: Phân tử gồm nhiều nguyên tử cấu tạo thành.
Để bạn hiểu rõ hơn về sự khác biệt này, hãy theo dõi bảng so sánh sau:
| Đặc điểm | Nguyên tử | Phân tử |
| Khái niệm | Là hạt có kích thước nhỏ nhất của một nguyên tố hóa học. Nguyên tử trung hòa về điện. Cấu tạo gồm: Lớp vỏ electron và phần hạt nhân. | Là hạt đại diện cho chất nên thể hiện đầy đủ tính chất của một chất. Phân tử gồm một hai nguyên tử trở lên liên kết với nhau bằng liên kết hóa học. |
| Ví dụ | Nguyên tử Oxi, nguyên tử H – hidro, nguyên tử nhôm Al, nguyên tử silic Si,… | O2, H2, Al2O3, (Phân tử khí oxi, phân tử khí hidro, phân tử nhôm oxit,…) |
| Mối quan hệ của chúng | Nguyên tử là hạt nhỏ, là đơn vị cấu thành nên phân tử | Phân tử được cấu thành từ nhiều nguyên tử thông qua liên kết ion hoặc cộng hóa trị. |
| Hình dạng đặc trưng | Hình cầu, dạng hạt tròn | Có nhiều hình dạng khác nhau, tùy loại chất. Ví dụ: Phân tử NaCl sẽ có hình dạng khác với phân tử nước. |
| Tính chất | Nguyên tử vốn dĩ đã là hạt nhỏ nhất nên không thể phân đôi hay tách rời nó ra thành đơn vị nhỏ hơn. | Có thể phân tách hoặc kết hợp với nhau (Sự thay đổi phụ thuộc vào liên kết được hình thành) |
| Liên kết được hình thành | Chính là liên kết hạt nhân | Liên kết ion, liên kết cộng hóa trị phân cực/không phân cực. Loại liên kết phụ thuộc vào hiệu độ âm điện của 2 nguyên tố. |
Một vài khái niệm liên quan tới phân tử là gì?
Khái niệm công thức phân tử kèm ví dụ
Công thức phân tử là một biểu thức, nó cho biết các loại nguyên tử cùng với số lượng của chúng có trong một phân tử (Một chất). Công thức phân tử cùng với cấu trúc của nó chính là hai yếu tố quan trọng nhất quyết định khả năng phản ứng hóa học của một chất.
Ví dụ: – Axit sunfuric có 2 nguyên tử Hidro, 1 nguyên tử lưu huỳnh và 4 nguyên tử oxi có công thức hóa học như sau: H2SO4.
- Đường glucose là một chất hữu cơ, gồm có 6 nguyên tử cacbon, 12 nguyên tử hidro và 6 nguyên tử oxi được viết là: C6H12O6.
Khối lượng phân tử là gì? Cách tính đơn giản
Khối lượng phân tử là một số được tính bằng tổng khối lượng nguyên tử của các nguyên tử trong phân tử. Khi bạn đã biết được khối lượng nguyên tử rồi thì việc tính khối lượng phân tử rất đơn giản, chỉ cần cộng lại với nhau là xong. Lưu ý: Nếu trong phân tử có nhiều nguyên tử của cùng một loại nguyên tố thì bạn cần phải nhân với số nguyên tử đó.
Ví dụ: Hãy thử tính khối lượng phân tử HNO3 (Axit nitric), ta có:
- Nguyên tử Hiđro có khối lượng là 1dvC, Nitơ có khối lượng là 14 dVC, oxi có khối lượng xấp xỉ 16 dvC.
Như vậy, khối lượng phân tử HNO3 là: 1+14+16×3 = 63 dvC.
Các liên kết trong phân tử có mấy loại?
Chúng ta đã biết rằng, phân tử là sự liên kết giữa hai hoặc nhiều nguyên tử lại với nhau. Vậy trong phân tử có những loại liên kết nào? Đó là liên kết ion và liên kết cộng hóa trị.
Liên kết ion trong phân tử có đặc điểm gì?

Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion có điện tích trái dấu nhau. Phần lớn loại liên kết này hình thành giữa hai nguyên tố kim loại điển hình và phi kim điển hình. Nói cách khác, đó là kim loại mạnh liên kết với phi kim mạnh.
Ví dụ như: NaCl, KCl, CaBr2,… Trong đó kim loại kiềm, kiềm thổ như Na, K, Ca đều được đánh giá là rất mạnh. Tương tự như vậy, phi kim Clo, Brom cũng có tính oxi hóa vượt trội.
Khi kết hợp với nhau, các nguyên tử sẽ tiến hành cho hoặc nhận electron. Nếu nguyên tử nào nhận electron thì nó sẽ mang điện tích âm, gọi là anion. Ngược lại, nguyên tử nào cho bớt electron thì nó sẽ mang điện tích dương, gọi là cation.
Đặc điểm của những hợp chất mang liên kết ion là:
- Liên kết giữa các nguyên tử bền vững nên có nhiệt độ sôi, nhiệt độ nóng chảy cao.
- Ở dạng rắn khan không dẫn điện mà chỉ dẫn điện khi nóng chảy và khi hòa tan trong nước.
- Cứng, dễ vỡ, thường không có màu, trong suốt
Liên kết cộng hóa trị trong phân tử có đặc điểm gì?
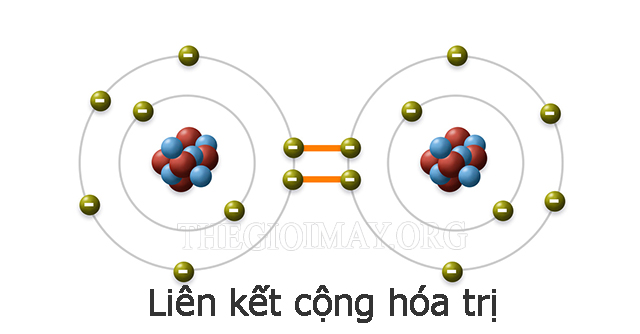
Liên kết cộng hóa trị hình thành giữa hai nguyên tử khi chúng cùng sử dụng một hoặc nhiều cặp electron chung. Mỗi một cặp e này sẽ tạo thành một liên kết cộng hóa trị.
Nếu phân chia nhỏ hơn thì liên kết cộng hóa trị còn được chia thành hai loại là:
- Liên kết cộng hóa trị phân cực: Liên kết có cặp e dùng chung bị lệch hẳn về một phía. Ở dạng liên kết này, những nguyên tử có độ âm điện cao hơn thì cặp electron sẽ hướng vào đó hơn.
- Liên kết cộng hóa trị không phân cực: Loại liên kết này thường gặp ở các phân tử được tạo từ 2 nguyên tử cùng loại (Ví dụ như chất khí). Vì hai nguyên tố có cùng độ âm điện hoặc có độ âm điện chênh lệch không nhiều nên cặp e dùng chung sẽ nằm ở giữa các nguyên tử.
Xác định loại liên kết phân tử như thế nào?
Để xác định xem một phân tử có chứa loại liên kết hóa học nào, bạn chỉ cần làm theo các bước sau đây:
- Đầu tiên, bạn cần biết được độ âm điện của các nguyên tố.
- Bước 2: Tính hiệu độ âm điện (Lấy giá trị tuyệt đối)
- Bước 3: So sánh với kết quả sau:
- Nếu hiệu độ âm điện của hai nguyên tố nhỏ hơn 0,4: Liên kết cộng hóa trị không phân cực.
- Nếu hiệu độ âm điện của hai nguyên tố trong phân tử nằm trong khoảng từ: 0,4 đến 1,7 thì đó là liên kết cộng hóa trị phân cực.
- Cuối cùng, hiệu độ âm điện lớn hơn 1,7 thì đó là liên kết ion.
Ví dụ: Phân tử FeS có hai nguyên tố là Fe và S. Trong đó, Fe có độ âm điện là: 1,83. S có độ âm điện là 2,58. Như vậy, hiệu độ âm điện của hai nguyên tố là: |1,83 – 2,58| = 0,75. Có thể nói, chất này mang liên kết cộng hóa trị phân cực với cặp electron nghiêng về phía nguyên tử lưu huỳnh.
Lời kết
Hy vọng rằng, qua bài viết trên, bạn đã hiểu được phân tử là gì, cùng với cách phân biệt nó với nguyên tử. Hãy ghé thăm website thegioimay.org thường xuyên để cùng Thế Giới Máy tìm hiểu các kiến thức hấp dẫn, bạn nhé!




